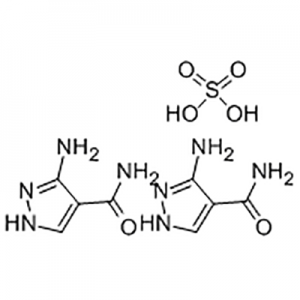
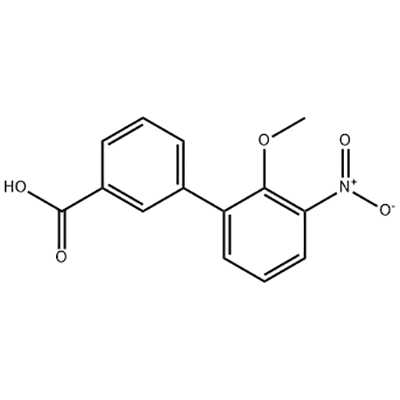
Acide 2′-méthoxy-3′-nitro-biphényl-3-carboxylique
Acide 2′-méthoxy-3′-nitro-biphényl-3-carboxylique
L'acide 2'-méthoxy-3'-nitro-biphényl-3-carboxylique est utilisé comme intermédiaire d'Eltrombopag.
Eltrombopag, développé par GlaxoSmithKline (GSK) au Royaume-Uni, puis développé conjointement avec Novartis en Suisse, est le premier et le seul agoniste des récepteurs TPO non peptidique à petite molécule approuvé au monde.Eltrombopag a été approuvé par la FDA américaine en 2008 pour le traitement du purpura thrombocytopénique idiopathique (PTI) et en 2014 pour le traitement de l'anémie aplasique sévère (AA).C'est également le premier médicament approuvé par la FDA américaine pour le traitement de l'AA au cours des 30 dernières années.
En décembre 2012, la FDA américaine a approuvé Eltrombopag pour le traitement de la thrombocytopénie chez les patients atteints d'hépatite C chronique (HCC), afin que les patients atteints d'hépatite C avec un mauvais pronostic en raison d'un faible nombre de plaquettes puissent commencer et maintenir un traitement standard à base d'interféron pour les maladies du foie.Le 3 février 2014, GlaxoSmithKline a annoncé que la FDA a accordé la qualification de médicament de traitement révolutionnaire à Eltrombopag pour le traitement de l'hémopénie chez les patients atteints d'anémie aplasique chimique sévère (AAS) qui n'ont pas complètement répondu à l'immunothérapie.Le 24 août 2015, la FDA américaine a approuvé Eltrombopag pour le traitement de la thrombocytopénie chez les adultes et les enfants âgés de 1 an et plus atteints de thrombocytopénie immunitaire chronique (PTI) qui ont une réponse insuffisante aux corticostéroïdes, aux immunoglobulines ou à la splénectomie.Le 4 janvier 2018, Eltrombopag a été approuvé pour être répertorié en Chine pour le traitement de la thrombocytopénie immunitaire primaire (PTI).



![pentaméthylène bis[1-(3,4-diméthoxybenzyl)-3,4-dihydro-6,7-diméthoxy-1H-isoquinoléine-2-propionate], dioxalate](http://cdn.globalso.com/jindunchem-med/image281-300x300.png)

![Acétate de caspungin; Acétate de caspofungin; Cancidas; Acétate de caspofungin [USAN:BAN:JAN];](http://cdn.globalso.com/jindunchem-med/fbe17385-300x300.jpg)